-
邀请演讲IVD产品主要由诊断试剂和诊断设备(仪器)构成。 体外诊断试剂按照医疗器械管理,也根据品种的风险程度由低到高,分为第一类、第二类和第三类。
根据国家药监局自2015年至2017年的统计,境内诊断试剂申请受理从3887件下降至2086件,进口诊断试剂受理从1702件下降至845件,整体申请数量有缩减的趋势,与国家近3年来政策调整和大力整顿与规范药品、医疗器械产品注册有关。从注册获批的情况来看,我国北京、广东、江苏、浙江是排名前4的境内第三类诊断试剂的注册大省(直辖市),占境内Ⅲ类IVD注册总数的60%以上。
图表1:2016-2018年新获批累计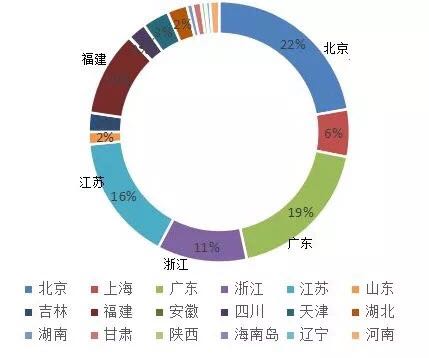
来源:国家医疗器械技术审评中心 前瞻产业研究院整理
以Ⅲ类医疗器械为例,自2016年至2018年期间,国家药监局共批准新的诊断试剂品种,境内(Ⅲ类)965件,境外(Ⅲ类)124件。在国内,致病性病原菌、肿瘤标志物和基因检测试剂成为主要获批品种。进口品种中主要是致病性病原菌、肿瘤标志物和变态反应检测试剂。
图表2: 境内第三类诊断试剂获批情况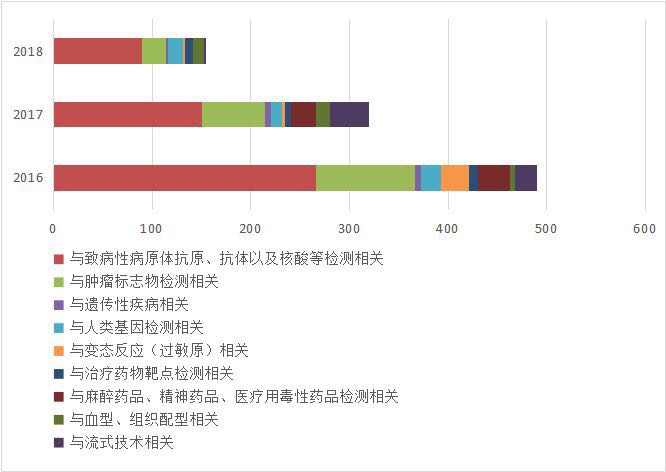
来源:国家医疗器械技术审评中心 前瞻产业研究院整理
图3:进口第三类诊断试剂获批情况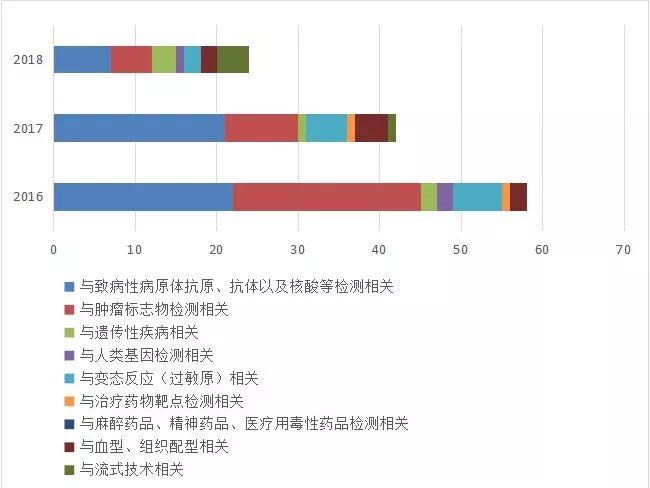
来源:国家医疗器械技术审评中心 前瞻产业研究院整理

扫一扫
下载《前瞻经济学人APP》进行提问
与资深行业研究员/经济学家互动交流让您成为更懂行业的人






























